Sezon jesienno – zimowy to bardzo gorący czas dla farmaceutów ze względu na wzmożony ruch pacjentów w aptekach. Pacjenci szukają nie tylko leków łagodzących objawy choroby, ale także preparatów wzmacniających układ odpornościowy. Ze względu na szeroką gamę produktów leczniczych, możemy polecić pacjentom preparaty z bogatym zestawem substancji czynnych. Warto jednak zastanowić się nad tym, co dzieje się z lekami po ich zażyciu. Na to pytanie postaramy się znaleźć odpowiedź w poniższym artykule.
Leki przeciwbólowe oraz przeciwgorączkowe stanowią powszechne rozwiązanie w łagodzeniu i zwalczaniu dolegliwości podczas infekcji organizmu. Oczywiście leki przeciwbólowe znajdują również inne zastosowania – chociażby w leczeniu bólów nowotworowych. Warto jednak zwrócić uwagę na ich złożone oddziaływanie na organizm, gdyż pełne zrozumienie działania tych leków może być kluczowe dla osób poszukujących skutecznych strategii leczenia przy jednoczesnej minimalizacji potencjalnego ryzyka i działań niepożądanych.
Losy leku w organizmie
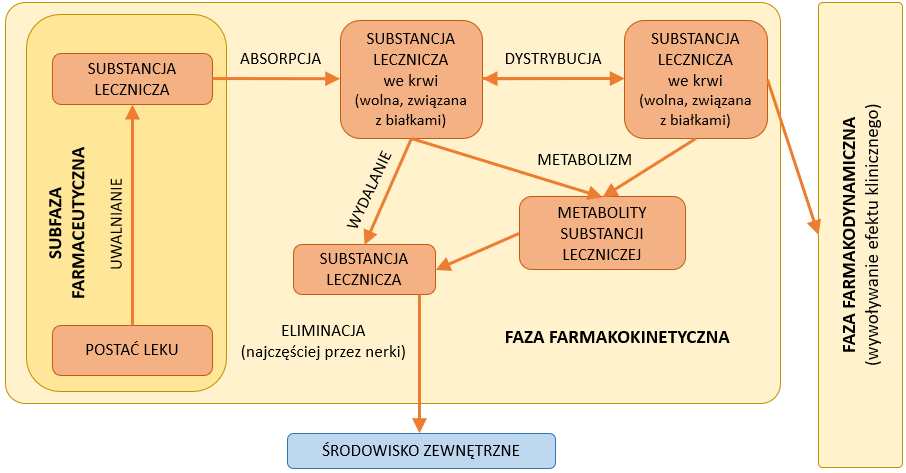
Procesy, które zachodzą z lekiem w organizmie po jego zażyciu, można podzielić na dwa etapy. Pierwsza faza (tzw. farmakokinetyczna) obejmuje procesy związane z LADME. Jest to akronim, który obejmuje następujące procesy:
- uwalnianie (ang. Liberation) – proces, w którym substancja czynna uwalniana jest z postaci leku;
- wchłanianie (ang. Absorption) – etap przenikania leku do krwiobiegu;
- dystrybucję (ang. Distribution) – czyli rozprowadzanie substancji czynnej po całym organizmie;
- biotransformację (ang. Metabolism) – procesy, w których substancja czynna ulega modyfikacjom chemicznym w organizmie;
- wydalanie (ang. Exctretion) – polega na usuwaniu leku i/lub jego metabolitów z organizmu.1
Faza farmakodynamiczna związana jest z oddziaływaniem leku na nasz organizm w celu wywołania określonego efektu leczniczego. Kontakt ten może opierać się na reakcji leku z receptorem. Kompleks lek – receptor powoduje wyzwolenie bodźca farmakologicznego, który w efekcie prowadzi do wystąpienia efektu farmakologicznego. Efekt ten nie będzie możliwy do zaobserwowania bez zajścia fazy farmakokinetycznej (Rys. 1). 1,2
Szczególną uwagę warto zwrócić na procesy biotransformacji i metabolizmu leków. Odgrywają one kluczową rolę w organizmie, wpływając na przemiany chemiczne substancji czynnych. Mogą one prowadzić m.in. do:
- aktywacji lub dezaktywacji leków,
- zmniejszenia toksyczności leków,
- indukowania lub hamowania enzymów i przemian chemicznych,
- powstawania toksycznych metabolitów.
Zrozumienie metabolizmu leków jest istotne zarówno dla skutecznego leczenia, jak i minimalizacji potencjalnych skutków ubocznych czy wystąpienia interakcji lekowych. 1,2
Niesteroidowe leki przeciwzapalne
Niesteroidowe leki przeciwzapalne (NLPZ) wykazują działanie przeciwzapalne, przeciwbólowe, przeciwgorączkowe oraz przeciwagregacyjne. Znalazły one szerokie zastosowanie w leczeniu bólu o nasileniu łagodnym do umiarkowanego, a także w reumatoidalnym zapaleniu stawów i chorobach reumatycznych. Mogą być prewencyjnie stosowane w chorobach układu sercowo – naczyniowego. Mechanizm działania NLPZ polega na hamowaniu czynności cyklooksygenazy (COX), która jest niezbędna do syntezy prostaglandyn.2,3
Do najbardziej popularnych leków z grupy NLPZ możemy zaliczyć kwas acetylosalicylowy oraz ibuprofen. Podczas stosowania NLPZ warto pamiętać o tym, aby stosować tylko jeden lek z grupy, stopniowo zwiększać dawkę (do maksymalnie tolerowanej dawki) oraz monitorować działania niepożądane – o ile występują. Obecnie wiele z nich jest dostępnych bez recepty (tzw. leki OTC), przez co mogą być nadużywane przez pacjentów. Ważne jest więc, aby informować pacjentów o właściwym stosowaniu leków z grupy NLPZ, choć jest to bardzo trudne.2,3,4
Metabolizm kwasu salicylowego oraz acetylosalicylowego
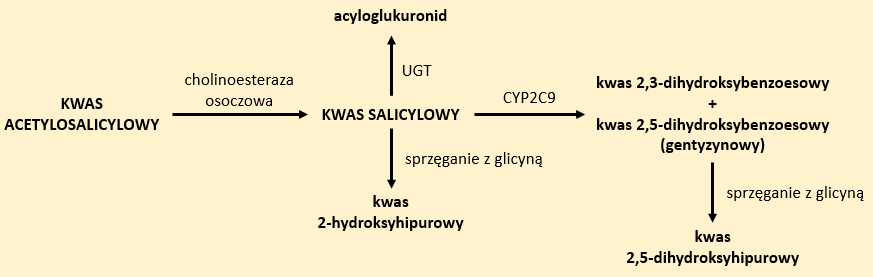
Kwas acetylosalicylowy (popularnie nazywany aspiryną) jest nieodwracalny inhibitorem COX-1. Poza dolegliwościami bólowymi, jest stosowany w leczeniu stanów gorączkowych towarzyszących przeziębieniom. W małych dawkach (do 150 mg) może być stosowany jako lek przeciwagregacyjny w chorobie niedokrwiennej serca. Działanie to może zostać zahamowane w wyniku jednoczesne stosowania przez pacjenta ibuprofenu. Jest on przeciwwskazany u dzieci poniżej 12. roku życia z uwagi na wywoływanie zespołu Reye’a (nieżyt górnych dróg oddechowych, wymioty, zaburzenia funkcjonowania układu nerwowego, napięcie mięśniowe).2
Kwas acetylosalicylowy ulega reakcji hydrolizy do kwasu salicylowego z udziałem cholinoesterazy osoczowej. Głównym szlakiem metabolizmu salicylanów jest reakcja sprzęgania z glicyną. Produktem reakcji jest kwas 2-hydroksyhipurowy. Znaczne przekroczenie dawki wysyca ten układ enzymatyczny – tylko 22% leku ulega przemianie, co powoduje zwiększenie powstawania innych metabolitów. W obecności enzymu CYP2C9 może ulegać utlenieniu do kwasów 2,3-dihydroksybenzoesowego i 2,5-dihydroksybenzoesowego (gentyzynowego). Kwas gentyzynowy w obecności glicyny może ulegać sprzęganiu do kwasu 2,5-dihydroksyhipurowego. Grupa acylowa kwasu salicylowego może ulegać reakcjom acylacji, w wyniku których będą powstawać acyloglukuronidy (Rys. 2). 5,6,7
Metabolizm ibuprofenu
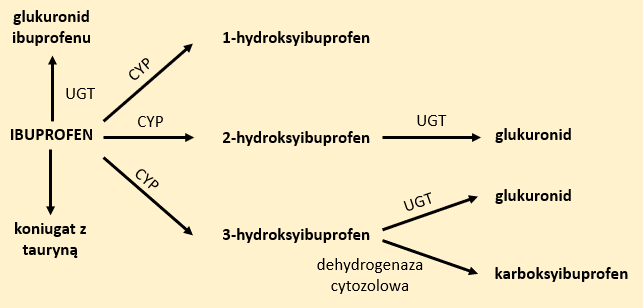
Z uwagi na obecność grupy karboksylowej, ibuprofen może ulegać reakcjom sprzęgania z:
- kwasem glukuronowym w obecności UGT-glukuronylotransferazy, w wyniku którego powstaje glukuronid;
- aminokwasem, w wyniku czego powstaje koniugat z tauryną.
Z powodu obecności grupy alkilowej, w obecności enzymów z grupy CYP będzie on ulegał reakcjom hydroksylacji, w wyniku których powstaną odpowiednio 1-, 2- lub 3-hydroksypochodne. W organizmie obserwuje się polimorfizm genów CYP2C8 i CYP2C9, co może powodować wzrost retencji ibuprofenu, a ostatecznie prowadzić do zwiększenia ryzyka wystąpienia działań niepożądanych (Rys. 3).5,6,8
W tym miejscu nie można pominąć o tzw. efekcie pułapowym, który można zaobserwować w przypadku tego leku. Zjawisko to polega na tym, że wraz ze zwiększaniem dawki leku ponad pewien poziom (pułap) nie zaobserwuje się zwiększenia jego skuteczności. W przypadku ibuprofenu zwiększanie dawki leku powyżej 400 mg nie zmniejszy odczuwanego bólu, a może tylko potęgować działania niepożądane, które mogą pojawić się po zastosowaniu tego leku. Warto zatem uświadamiać i edukować pacjentów w zakresie tego typu informacji.9
Pochodne p-aminofenolu
Wśród pochodnych p-aminofenolu wyróżnia się fenacetynę oraz paracetamol. W artykule zostanie omówiony paracetamol z uwagi na to, że jest on bardzo popularną substancją stosowaną w różnego rodzaju preparatach leczniczych.2
Paracetamol wykazuje działanie przeciwbólowe oraz przeciwgorączkowe. W przeciwieństwie do wcześniej omówionej grupy, nie wykazuje działania przeciwzapalnego oraz przeciwagregacyjnego. Z tego właśnie powodu nie jest zaliczany do grupy NLPZ. Jego dokładny mechanizm działania nie jest w pełni zrozumiany, ale istnieje kilka teorii dotyczących tego, jak działa. Wśród nich wyróżnia się następujące tezy:
- jest inhibitorem cyklooksygenazy COX-3,
- hamuje aktywność syntazy tlenku azotu (II),
- jest agonistą receptorów kannabinoidowych CB1,
- aktywuje zstępujące szlaki serotoninergiczne.2,5,6,10
Metabolizm paracetamolu
Metabolizm paracetamolu odbywa się głównie na drodze nieoksydacyjnej poprzez reakcje sprzęgania z kwasem glukuronowym z udziałem enzymu UDP-glukuronylotransferazy (UGT) lub z aktywnym siarczanem w obecności sulfotransferazy (SULT). W przypadku noworodków, niemowląt i dzieci do 6 roku życia, ze względu na niewystarczającą aktywność enzymów uczestniczących w reakcjach glukuronidacji, głównym produktem metabolizmu paracetamolu jest siarczan. Z kolei u dorosłych są to glukuronidy (Rys. 4).5,6,10,11
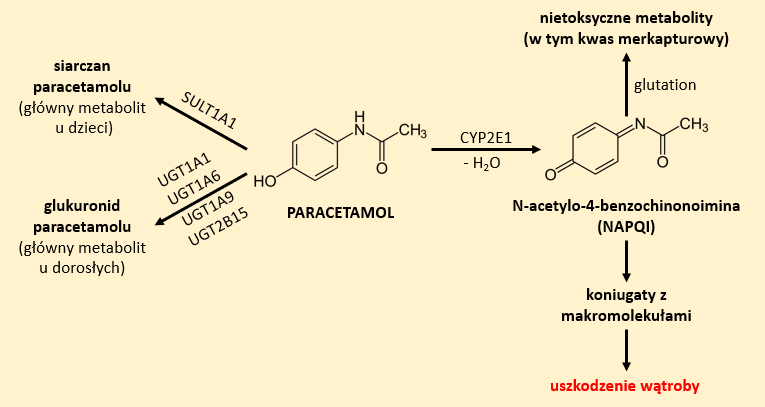
Niewielka część paracetamolu ulega metabolizmowi na drodze utleniania do 3-hydroksyparacetamolu lub N-acetylo-p-benzochinonoiminy (NAPQI). Ten ostatni to bardzo reaktywny związek, który w organizmie ulega inaktywacji poprzez wiązanie z glutationem. W wyniku tej reakcji powstaje kwas merkapturowy. W przypadku przedawkowania paracetamolu dochodzi do wysycenia enzymatycznych układów odpowiedzialnych za sprzęganie tego leku. Wówczas dominuje droga oksydacyjna, w wyniku której dochodzi do wzmożonej syntezy toksycznego NAPQI. Szczególnie zagrożone są nerki, gdzie obserwuje się wysoką aktywność CYP2E1.
Na uszkodzenie polekowe tkanek szczególnie narażone są dzieci, osoby nadużywające alkoholu oraz pacjenci przyjmujący induktory CYP2E1 (np. barbiturany, izoniazyd). W wyniku zatrucia paracetamolem może dojść do uszkodzenia komórek wątroby (hepatocytów), w wyniku czego może dojść do wzrostu aktywności aminotransferaz (AspAT i AlAT). Dlatego też paracetamolu nie powinni zażywać chorzy z przewlekłym zapaleniem lub marskością wątroby.5,6,10,11W przypadku pacjentów pediatrycznych z dolegliwościami bólowymi należy zwrócić uwagę na wiek pacjenta. Paracetamol może być stosowany już od pierwszych dni życia. Z kolei ibuprofen dopiero od 3-ego miesiąca życia. W tabeli przedstawiono dawki jednorazową oraz dobową, jakie można podać dzieciom (Tab. I).12,13
Tabela I. Dawkowanie ibuprofenu oraz paracetamolu u dzieci.
| Ibuprofen | Paracetamol | |
| Dawka jednorazowa | 5 – 10 mg/kg m.c. | 10 – 15 mg/kg m.c. |
| Dawka dobowa | 40 mg/kg m.c. | 60 mg/kg m.c. |
Bezwzględnie nie należy stosować kwasu acetylosalicylowego u dzieci z uwagi na możliwość wystąpienia działań niepożądanych, w tym zespołu Rey’a.2
W kolejnej części artykułu zostaną omówione opioidy, a także przedstawione zostaną wskazówki na temat sposobu rozmawiania z pacjentem na temat bólu.
Damian Pielorz
Źródła:
- Sznitowska M., Biofarmacja. Wrocław, Polska: Edra Urban Partner; 2023.
- Janiec W., Kompendium farmakologii. Warszawa, Polska: Wydawnictwo Lekarskie PZWL; 2021.
- Borysewicz K., NLPZ – nowy etap? Przegląd Reumatologiczny 2005, 2-3.
- Graham P., Chemia medyczna. Warszawa, Polska: Wydawnictwo Naukowe PWN; 2019.
- Zejc A., Gorczyca M., Chemia leków – podręcznik dla studentów farmacji i farmaceutów. Warszawa, Polska: Wydawnictwo Lekarskie PZWL; 2008.
- Pawłowski M., Chemia leków. Warszawa, Polska: Wydawnictwo Lekarskie PZWL; 2020.
- CHPL Etopiryna Kontrol 300 mg + 50 mg.
- Zuckerman G.B., Uy C.C., Shock, metabolic acidosis and coma following ibuprofenoverdose in a child. Ann. Pharmacother 1995, 29.
- Redakcja portalu Opieka.farm, Efekt pułapowy, https://opieka.farm/efekt-pulapowy/ [Dostęp 24.01.2024].
- Twycross R., Booth S., Byrne A. et al. Paracetamol. Z tłumaczenia: Progress in Palliative Care 2000, 4.
- Van der Marel C.D., Anderson B.J., van Lingen R.A. et al. Paracetamol and metabolite pharmacokinetics in infants. Eur. J. Clin. Pharmacol. 2003, 59.
- CHPL Paracetamol.
- CHPL Ibuprofen B.Braun, 200 mg/50 ml.