Problem antybiotykooporności ujawnia się wszędzie – również (a może przede wszystkim) w szpitalach. Czy znamy już rozwiązania, które skutecznie pozwoliłyby nam z nim walczyć w tym środowisku? Naukowcy wciąż poszukują idealnego środka, ale zdaje się, że są na dobrej drodze.
Interwencje chirurgiczne i hospitalizacja są przyczyną około 22% zakażeń związanych z opieką zdrowotną. Choroby wywołane przez bakterie mogą wydłużyć pobyt pacjenta w szpitalu średnio o 7-10 dni. Głównymi winowajcami tej sytuacji są szczepy lekooporne ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa i Enterobacter).1 Stanowią one bardzo poważny problem w opiece nad pacjentem, utrudniając prawidłowe gojenie się ran pooperacyjnych.
Aktualnie na rynku mamy dostęp do opatrunków specjalistycznych zawierających m.in. antybiotyki, jony metali i węgiel aktywny. Każdy z nich ma charakterystyczne dla siebie działanie – bakteriobójcze lub bakteriostatyczne. Niestety, przez ostatnie kilka dekad oporność na leki przeciwdrobnoustrojowe niepokojąco wzrosła i teraz jest ona globalnym problemem. Jak możemy sobie z nim poradzić? Oto 3 najnowsze propozycje z naukowego podwórka.
Srebrny standard w zakażeniach ran pooperacyjnych – naturalny biopolimer i nanocząstki Ag
Na początku 2020 roku zespół naukowców z University of Arkansas zdefiniował mechanizm działania nanocząstek srebra. Badacze Profesora Y. Wanga odkryli, że jony srebrowe powodują dehybrydyzację helisy DNA i jej dysocjację do pojedynczych nici w genach komórek E. coli. Później następuje osłabienie połączeń na poziomie białko-DNA, co prowadzi do denaturacji DNA i RNA, zahamowania procesu replikacji i w konsekwencji do śmierci superbakterii, czyli bakterii wielolekoopornych.2
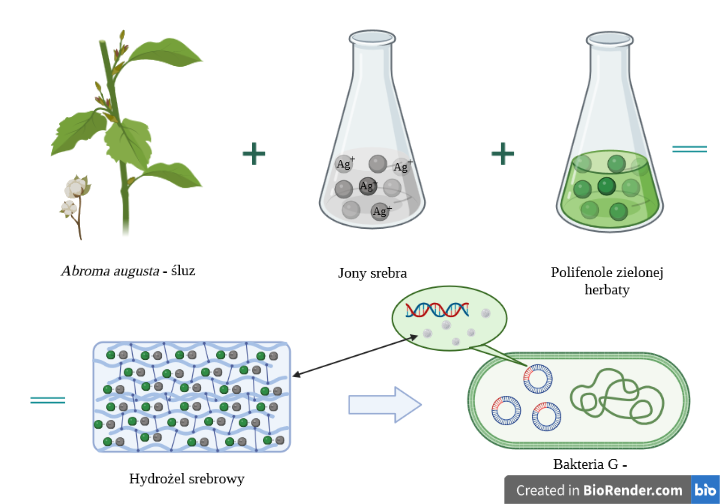
W procesie transportu cząstek metalu kluczową rolę odgrywa nośnik. Jedną z nowatorskich propozycji jest esencja otrzymywana z liści i korzeni rośliny śluzowatej – Abroma augusta Linn (Devil’s cotton). Pozyskany ekstrakt jest dobrze rozpuszczalnym w wodzie kwaśnym polisacharydem zbudowanym z łańcuchów kwasu glukuronowego i ramnozy. Dzięki swoim wyjątkowym właściwościom hydratowany związek zachowuje fizyczną formę żelu w warunkach pokojowych.2
Ten naturalnego pochodzenia hydrożel jest bezsmakowy, bezwonny, gęsty, samostabilizujący się i zdolny do przenoszenia jonów Ag+ oraz polifenoli zielonej herbaty (Rys. 1). Zapewnia to lepsze wiązanie nanocząstek srebra, a co za tym idzie skuteczniejsze działanie bakteriobójcze – jest on zatem alternatywą dla tradycyjnych nośników takich jak bazy w przypadku kremów czy maści. Warto zauważyć, że sam biopolimer nie hamuje rozwoju bakterii i grzybów, więc jego działanie będzie zależało od aktywności zawartego w nim związku.2
Jak możemy wspierać naturalne mechanizmy obronne? – witamina D3
W jednych z badań przedklinicznych głównym celem dla naukowców było połączenie bioaktywnej witaminy D3 z nanowłóknami PCL, aby wzmocnić działanie układu immunologicznego. 1α,25-dihydroksywitamina D3, czyli kalcytriol, odpowiada m.in. za zwiększoną produkcję peptydów przeciwdrobnoustrojowych (LL-37), które chronią nas przed infekcjami. Zespół profesora A. Gombarta przeprowadził próbę na myszach transgenicznych w celu zbadania działania kalcytriolu. Test polegał na indukcji genu cAMP poprzez podanie na łożysko rany nanowłókien obciążonych odpowiednią ilością 1,25(OH)2D3.3
Analiza metodą cytometrii przepływowej potwierdziła zwiększoną odpowiedź immunologiczną keratynocytów, fibroblastów i komórek śródbłonka, co przyczyniło się do przyspieszenia regeneracji i zapobieżenia infekcji bakteryjnej po uszkodzeniu tkanki. Naukowcy wykonali dodatkowy test barwienia immunofluorescencyjnego, który wykazał brak ekspresji genu cAMP poza miejscem urazu – w oddalonych od uszkodzenia partiach skóry występowała niska produkcja (LL-37). Eksperci powtórzyli doświadczenie na komórkach ludzkich – umieścili włókna PCL obciążone witaminą D3 w ranie skóry o głębokości 1 mm i zaobserwowali równie obiecujące rezultaty (Rys. 2). Prace nad materiałami do osadzania kalcytriolu są w toku i być może wkrótce osiągną bardziej zaawansowany etap.3

Co oferują nam nanomateriały? Tlenek grafenu – wielofunkcyjny związek o działaniu przeciwbakteryjnym
Tlenek grafenu – GO – wyglądem przypomina plaster miodu. Dzięki wysokiej biokompatybilności i przestrzennemu rozmieszczeniu atomów może on oddziaływać na pojedyncze komórki bakteryjne oraz patogeny tworzące biofilm. Jego aktywność przeciwdrobnoustrojową określono w teście dyfuzyjnym na płytce agarowej. Szczepy superbakterii okazały się wrażliwe na GO, jednocześnie wykazując całkowitą oporność na antybiotyki takie jak: CFM (cefotaksym), AMX (amoksycylinę), COT (kotrimoksazol) i IMP (imipenem). Dla gentamycyny, azytromycyny i ciprofloksacyny zaobserwowano strefę zahamowania o średnicy 7-29 mm, natomiast dla tlenku grafenu – 27-41 mm.4
Przy pomocy zaawansowanych technik mikroskopowych wykazano istnienie ostrych krawędzi w strukturze tlenku grafenu. Swoją funkcją (rozcinanie patogenu) przypominają działanie “nano-noży”. W efekcie zaburzają integralność błony komórkowej, uszkadzają fosfolipidy i upośledzają funkcje życiowe (oddychanie, transport materiału budulcowego czy transformację sygnałów energetycznych), co prowadzi do całkowitej lizy błony bakteryjnej.
Innym mechanizmem, który może przyczyniać się do zwalczania infekcji, jest zdolność do zamykania pojedynczych komórek (znajdujących się poza biofilmem) w klatce stworzonej z tlenku grafenu. Uwięzione mikroorganizmy tracą dostęp do składników odżywczych, jonów i gazów, które są niezbędne dla ich procesów metabolicznych. Wraz ze wzrostem powierzchni bocznej tlenku grafenu zwiększa się również efekt hamowania wzrostu bakterii. Niedawne odkrycia dotyczące przeciwdrobnoustrojowych właściwości GO stały się motorem napędowym do badań nad zdefiniowaniem kolejnych potencjalnych mechanizmów bakteriobójczych tlenku grafenu.4
Czy niebawem będziemy świadkami swoistej rewolucji w zakresie leczenia zakażeń ran? Czas pokaże, jednak mamy solidne podstawy, by sądzić, że tak właśnie się stanie.
Michalina Cioczek
Źródła:
- Roy A, Srivastava SK, Shrivastava SL, Mandal AK. Hierarchical Assembly of Nanodimensional Silver–Silver Oxide Physical Gels Controlling Nosocomial Infections. ACS Omega. 2020;5(50):32617–32631. https://doi.org/10.1021/acsomega.0c04957
- Sadoon AA, Khadka P, Freeland J, Gundampati RK, Manso RH, Ruiz M, Krishnamurthi RK, Thallapuranam SK, Chen J, Wang Y. Silver Ions Caused Faster Diffusive Dynamics of Histone-Like Nucleoid-Structuring Proteins in Live Bacteria. Appl. Environ. Microbiol.2020;86(6):e02479-19. https://doi.org/10.1128/AEM.02479-19
- Jiang J, Zhang Y, Indra AK, Ganguli-Indra G, Le MN, Wang H, Hollins RR, Reilly DA, Carlson MA, Gallo RL, Gombart AF, Xie J. 1α,25-dihydroxyvitamin D3-eluting nanofibrous dressings induce endogenous antimicrobial peptide expression. Nanomedicine (Lond.). 2018;13(12):1417–1432. https://doi.org/10.2217/nnm-2018-0011
- Aunkor TH, Raihan T, Prodhan HP, Metselaar HSC, Malik SUF, Azad AK. Antibacterial activity of graphene oxide nanosheet against multidrug resistant superbugs isolated from infected patients. R. Soc. Open Sci. 2020;7:200640. https://doi.org/10.1098/rsos.200640

