Leki przeciwbólowe są bardzo popularnymi preparatami stosowanymi przez pacjentów. Z uwagi na szerokie zastosowanie preparatów z tej grupy, obecnie wyróżnia się m.in. niesteroidowe leki przeciwzapalne (NLPZ) oraz leki opioidowe (narkotyczne). Te pierwsze są zaliczane do tzw. grupy OTC. Te drugie są podawane z przepisu lekarza. Poza właściwościami farmakodynamicznymi warto zwracać uwagę na właściwości farmakokinetyczne, gdyż efekt leczniczy nie jest możliwy bez zajścia procesów oznaczonych akronimem LADME.
W poprzednim artykule omówiony został metabolizm paracetamolu oraz wybranych leków z grupy NLPZ. Nadszedł czas, aby przyjrzeć się przemianom leków opioidowych.
Narkotyczne (opioidowe) leki przeciwbólowe
Narkotyczne leki przeciwbólowe wykazują działanie agonistyczne wobec receptorów opioidowych. Ich pobudzenie wywołuje efekt przeciwbólowy oraz hamowanie ośrodka oddechowego. Do przedstawicieli tej grupy leków zalicza się m.in. alkaloidy opium i ich pochodne (np. morfinę, kodeinę, hydromorfon, oksykodon), pochodne syntetyczne (np. metadon, petydynę, tramadol). Buprenorfina, nalbufina oraz pentazocyna zaliczane są do leków o działaniu agonistyczno – antagonistycznym.1,2,3
Metabolizm morfiny
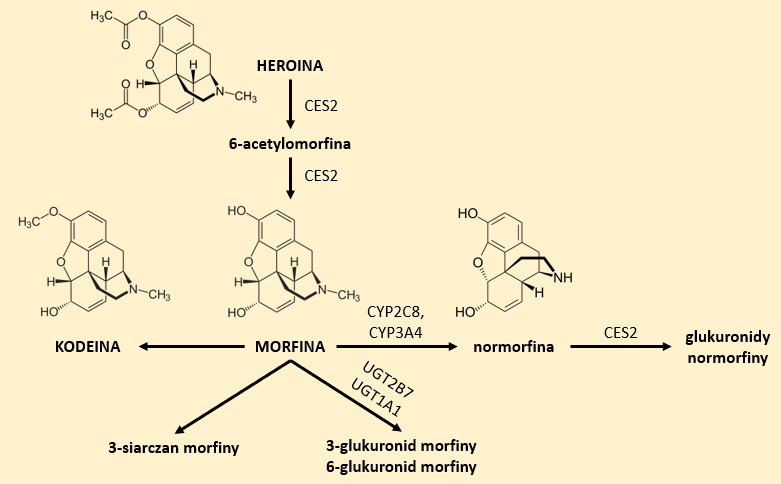
Morfina, zaliczana do alkaloidów fenantrenowych, znajduje zastosowanie w leczeniu bólów ostrych i przewlekłych o znacznym nasileniu, a także w bólach nowotworowych. Wykazuje również działanie przeciwkaszlowe, jednak obecnie nie stosuje się jej w preparatach o tych właściwościach (wyjątek! – może być wykorzystana w hamowaniu odruchu kaszlu wywołanego zranieniem opłucnej). Z uwagi na niewielki efekt farmakodynamiczny po podaniu doustnym, wynikający ze słabego wchłaniania z przewodu pokarmowego oraz szybki metabolizm, podawana jest dożylnie, domięśniowo, nad- i podoponowo.1,3 Morfina nie kumuluje się w organizmie. Głównym szlakiem przemian morfiny w organizmie są reakcje glukuronidacji z udziałem UDP-glukuronylotransferazy (UGT). Produktami tych reakcji jest nieaktywny 3-glukuronid oraz częściowo aktywny 6-glukuronid morfiny, który powstaje przy długotrwałym podawaniu doustnym morfiny. W niewielkim stopniu utlenia się do normofiny z udziałem CYP3A4 i CYP2C8. Morfina może ulegać również reakcjom sprzęgania z kwasem siarkowym. W wyniku O-metylacji może przekształcać się do kodeiny. Morfina może być produktem metabolizmu heroiny z udziałem karboksyloesterazy 2 (CES 2) (Rys. 1).1,4-6
Metabolizm kodeiny
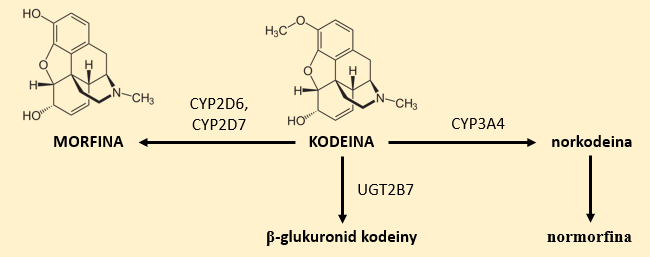
Kodeina to naturalny alkaloid opium, który wykazuje działanie przeciwbólowe i przeciwkaszlowe. W organizmie może ulegać reakcjom:
- O-demetylacji do morfiny w obecności CYP2D6, CYP2D7,
- N-demetylacji do norkodeiny w obecności CYP3A4,
- glukuronidacji do glukuronidu w obecności UGT2B7 (Rys. 2).
U populacji pediatrycznej obserwowane jest zjawisko tzw. „wybuchu morfinowego”. Jest to związane z silną aktywnością CYP2D6, który przekształca kodeinę do morfiny. Dlatego też nie zaleca się podawania preparatów z kodeiną u dzieci do 12 roku życia.1,7-9
Istotnym aspektem, o którym często się zapomina, jest polimorfizm. To zjawisko występowania różnych odmian tego samego genu, co warunkuje pojawianie się różnych cech u ludzi. Wykształca się podczas przystosowywania się organizmu do nowych warunków środowiska. W przeciwieństwie do mutacji dotyczy więcej niż 1% populacji. Powyższe zjawisko można zaobserwować w przypadku metabolizmu kodeiny z udziałem CYP2D6. W przypadku pacjentów tzw. poor metabolizer (PM), obserwuje się mniejsze działanie przeciwbólowe kodeiny. Natomiast u pacjentów należących do populacji tzw. extensive metabolizer (EM) i ultrafast metabolizer (UM) obserwuje się przyspieszony metabolizm kodeiny, w wyniku czego będzie dochodziło do zbyt szybkiego powstawania aktywnych metabolitów. To z kolei może skutkować występowaniem licznych działań niepożądanych. Polimorfizm kodeiny jest istotnym powodem, dla którego nie stosuje się go u dzieci.7-11
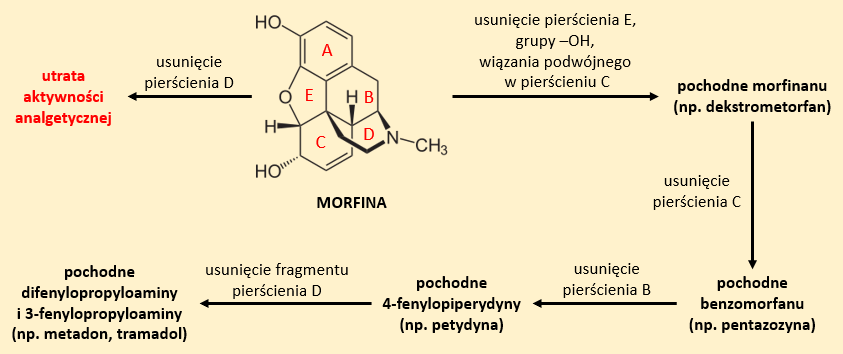
Cząsteczki morfiny oraz kodeiny, poddane chemicznym modyfikacjom strukturalnym, mogą ulec przekształceniu do pochodnych morfinanu, benzomorfanu, 4-fenylopiperydyny oraz pochodnych difenylopropyloaminy i 3-fenylopropyloaminy. Modyfikacje te obejmują m.in. usunięcie pierścieni B, C, E. W ten sposób możliwe jest otrzymywanie np. dekstrometorfanu, pentazocyny, petydyny (Rys. 3).3
Metabolizm oksykodonu i hydrokodonu
Głównym szlakiem enzymatycznym oksykodonu i hydrokodonu jest utlenianie do odpowiednio oksymorfonu i hydromorfonu z udziałem CYP2D6 (reakcja O-demetylacji). Istotne znaczenie ma także reakcja N-demetylacji do nor-utlenionych pochodnych (noroksykodon, norhydrokodon) z udziałem izoenzymów CYP3A4, CYP2C19 (Rys. 4). W przypadku oksykodonu za efekt przeciwbólowy w niewielkim stopniu odpowiada oksymorfon. Nieznaczna część oksykodonu ulega rozkładowi w procesie 6-ketoredukcji.12,13
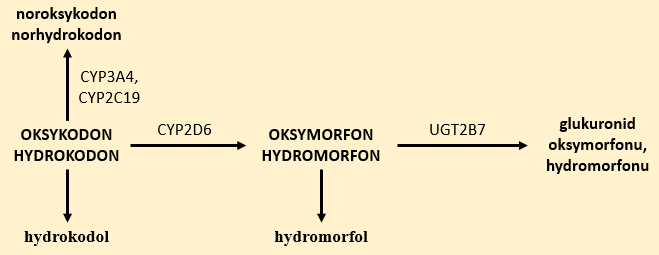
Metabolizm fentanylu
Fentanyl to lek opioidowy o silnym działaniu przeciwbólowym. W wątrobie metabolizuje głównie do nieaktywnego norfentanylu w obecności CYP3A4. W obecności CYP i O-metylotransferazy katecholowej (COMT) metabolizuje do hydroksy- i hydroksymetoksyfentanylu.11,14
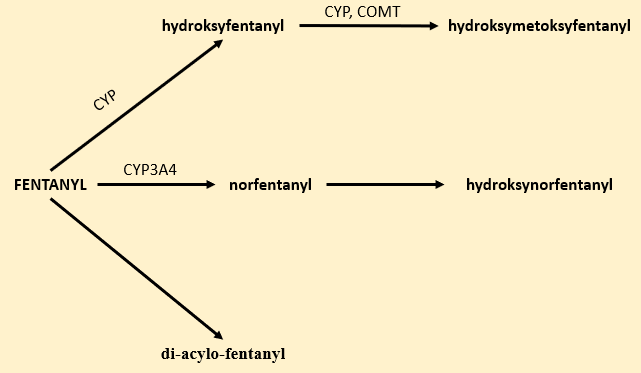
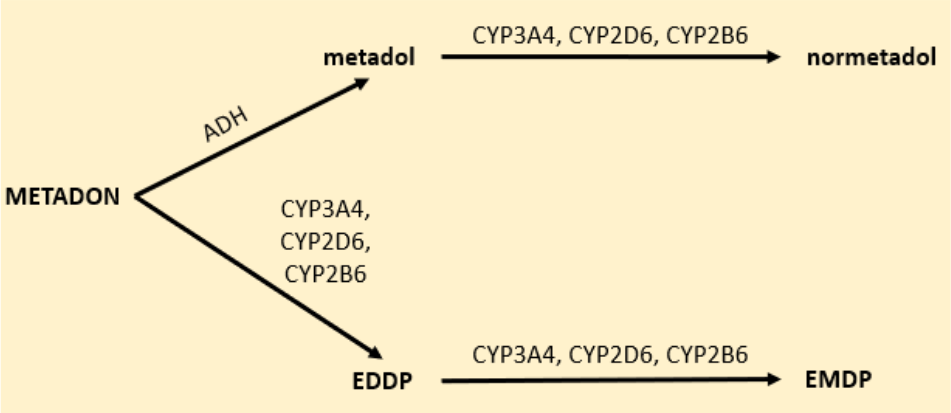
Metabolizm metadonu
Metadon jako jedyny związek z grupy opioidów ulega reakcji utleniania w obecności dehydrogenazy alkoholowej (ADH). Enzym ten katalizuje reakcje utleniania alkoholi i aldehydów w cytozolu i mitochondriach. Produktem przemiany tego leku z udziałem ADH jest metadol, który może ulec reakcji N-demetylacji do normetadolu z udziałem CYP3A4. Dodatkowo, w obecności izoenzymów CYP3A4, CYP2D6 i CYP2B6, dochodzi do syntezy nieaktywnych metabolitów metadonu (EDDP, EMDP), które mogą być wykorzystane do szybkich testów immunochromatograficznych do wykrywania metadonu (Rys. 6). EDDP stanowi lepszy marker moczu dla utrzymania metadonu niż metadon niezmetabolizowany. Kaseta szybkiego testu daje wynik dodatni, gdy stężenie EDDP w moczu przekracza 100 ng/ml (wartość graniczna).11,15-16
Jak rozmawiać z pacjentem w aptece na temat bólu?
Rozmawiając z pacjentem w aptece na temat bólu, istotnych jest kilka czynników, które umożliwią przeprowadzenie skutecznej porady. W czasie całej rozmowy warto traktować pacjenta z empatią i okazywać zrozumienie. Kluczowy jest również sposób prowadzenia rozmowy. Należy zadawać pytania otwarte, aby umożliwić pacjentowi swobodne wyrażanie swoich odczuć i doświadczeń związanych z bólem. Warto pytać o charakter bólu (np. pulsujący, ostry) oraz o miejsce jego występowania. W tym celu mogą pomóc pytania, takie jak np.:
- „W którym miejscu Pana/Panią boli?”,
- „Od kiedy odczuwa Pani ból?”,
- „Na jakiego rodzaju ból ma ten lek zadziałać?”.
Warto poprosić pacjenta o określenie intensywności bólu (np. z wykorzystaniem skali liczbowej od 0 do 10) oraz zorientować się, czy pacjent przyjmuje również inne leki. Omówienie z pacjentem jego dolegliwości bólowych umożliwi trafniejsze dopasowanie odpowiedniego leku. Precyzyjne pytania pomogą zrozumieć rzeczywiste potrzeby pacjenta. Należy również pamiętać o uwzględnieniu indywidualnych różnic każdego pacjenta i dostosowanie stylu rozmowy do konkretnych potrzeb danej osoby.
Po przeprowadzeniu dokładnego wywiadu warto udzielić informacji na temat dostępnych leków przeciwbólowych (dawkowanie, długość leczenia, ewentualnie działania niepożądane).
Podsumowanie
Poznanie metabolizmu leków przeciwbólowych jest istotne z kilku powodów. Przemiany chemiczne leków mogą różnić się między pacjentami, co wynika bezpośrednio z różnych fenotypów metabolizmu. Wpływa to na skuteczność i bezpieczeństwo danego leku. Zrozumienie mechanizmu procesów, jakie zachodzą w organizmie po zażyciu leków, pozwala na ocenę potencjalnych skutków ubocznych, interakcji z innymi lekami i ewentualnego ryzyka związanego z długotrwałym stosowaniem. Warto pamiętać, że równoczesne stosowanie innych leków może indukować lub hamować aktywność leków przeciwbólowych. W Tabeli I. przedstawiono przykłady inhibitorów CYP2D6, CYP3A4 oraz induktorów CYP3A4, które mogą oddziaływać na szlaki metaboliczne leków opioidowych, w których biorą udział wyżej wspomniane izoenzymy CYP. W efekcie może dojść do zwiększenia lub zmniejszenia aktywności opioidów.
Tabela I. Przykłady leków wpływających na biotransformację i metabolizm opioidów.
| INHIBITORY CYP3A4 | INDUKTORY CYP3A4 | INHIBITORY CYP2D6 |
| leki psychotropowe blokery kanału wapniowego fluorochinolony azolowe leki p/grzybicze leki p/arytmiczne | statyny fenobarbital glikokortykosteroidy leki p/padaczkowe | leki psychotropowe leki p/arytmiczne leki p/histaminowe |
Różnice w metabolizmie leków mogą wpływać na skuteczność leczenia. Osoby metabolizujące leki szybko mogą wymagać wyższych dawek, aby osiągnąć pożądane efekty terapeutyczne, podczas gdy osoby metabolizujące wolniej mogą doświadczać dłuższego działania leku przy niższych jego dawkach. Wiedza o metabolizmie leków może zatem pomóc w dostosowaniu terapii do indywidualnych potrzeb pacjenta.
Damian Pielorz
Źródła:
- Janiec W., Kompendium farmakologii. Warszawa, Polska: Wydawnictwo Lekarskie PZWL; 2021.
- Zejc A., Gorczyca M., Chemia leków – podręcznik dla studentów farmacji i farmaceutów. Warszawa, Polska: Wydawnictwo Lekarskie PZWL; 2008.
- Pawłowski M., Chemia leków. Warszawa, Polska: Wydawnictwo Lekarskie PZWL; 2020.
- Sjogren P., Żylicz Z., Następstwa kliniczne metabolizmu morfiny. Polska Medycyna Paliatywna 2004, 3(2), 101 – 117.
- Kotlińska – Lemieszek A., Bączyk E., Ciałkowska – Rysz A., Łuczak J., Morfina w leczeniu bólu u pacjentów z zaawansowaną chorobą nowotworową. Czy dobrze znamy ten lek? Jak go bezpiecznie stosować? Medycyna Paliatywna 2010, 2, 67 – 80.
- CHPL Paracetamol Biofarm, 500 mg, tabletki.
- Rydzik – Strzemska E., Strzemski M., Kodeina, https://farmacja.pl/kodeina/ [Dostęp 24.01.2024].
- CHPL Ascodan, 400 mg + 8 mg.
- Woroń J., Filipczak – Bryniarska I., Wordliczek J., Co o izoenzymie 2D6 cytochromu P450 każdy anestezjolog wiedzieć powinien? Anestezjologia i Ratownictwo 2011, 5, 118 – 121.
- Sznitowska M., Biofarmacja. Wrocław, Polska: Edra Urban Partner; 2023.
- Woroń J., Opioidowe leki przeciwbólowe. Chirurgia po Dyplomie 2017, 6.
- Dzierżanowski T., Ciałkowska – Rysz A., Oksykodon – lek pierwszego rzutu w leczeniu silnego bólu nowotworowego. Medycyna Paliatywna 2010, 3, 123 – 131.
- CHPL OxyContin, 5 mg.
- CHPL Submena, 100 mikrogramów.
- Leppert W., Rola metadonu w leczeniu bólu u chorych na nowotwory. Medycyna Paliatywna 2012, 1, 1 – 12.
- https://polish.custom-monoclonalantibody.com/sale-3166531-eddp-methadone-metabolite-diagnostic-drug-of-abusetest-kits-reader-cassette-in-human-urine-with-ce-c.html [Dostęp 24.01.2024]